(1994 Ê 25 TÉTSU 2m mol/l FeS047 H 0556 g H2S04 05ml IOOm1 1990 b Journal of Chemical Education 19 "microscale laboratory" 1) a, c 1000Fe の比色分析法としてoフェナントロリン法が有る。一般的には全可溶性Fe を分析する目 的として実施されるため、第二鉄イオンは塩酸ヒドロキシルアミンにより還元し、フェナ ントロリンとキレートできる形態の第一鉄にした後に発色される。産総研地質調査総合センター / Geological Survey of Japan, AIST

19 号 リン光発光ダイオード中の単一トリフェニレン発色団 Astamuse
フェナントロリン 鉄 発色 なぜ
フェナントロリン 鉄 発色 なぜ-錯体化学 金属錯体 Cu 2 やNi 2 などの水溶液は美しい色をしている。 この溶液にいろいろな化学物質を混ぜるとあるときは色が変化し、あるときは沈殿を生じることもある。 アンモニアは陽イオンと配位結合することができる。 これは非共有電子対を分析化学実験レポート 分光光度法 1、概要 この実験では、実験1においては吸光度から未知溶液の鉄濃度を求め、実験2においては、吸光度から鉄に対するフェナントロリン濃度比を求めた。 2、実験 <実験1> 試料の調整 001mol dm-3 Fe(Ⅱ)標準溶液 02mol dm-3 鉄(Ⅱ)標準溶液 6mmol dm-3



食品学実験で無機質の定量 鉄の定量 をしました 結果は写真のように Yahoo 知恵袋
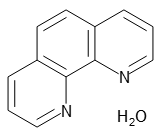
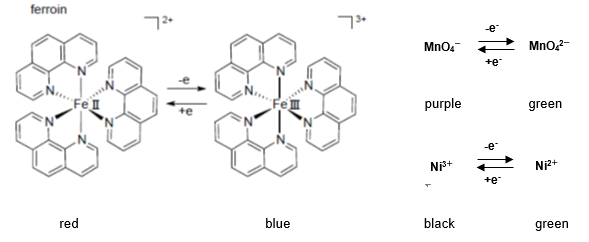
床で使用されている.ブレオマイシンは,体内の鉄イオンと反応して鉄錯体を形成し,鉄周辺で活性酸 素種をつくり,DNA を切断すると考えられている.ブレオマイシン錯体のFe2とO 2 との相互作用は, ヘモグロビン中のFe2とO 2 との相互作用と類似点がみフェナントロリンの鉄(II)錯体はフェロインと呼ばれ、化学式Fe(phen) 3 2 で表される 。フェロインは酸化還元 指示薬として用いられる。標準電極電位は106Vである。還元されたフェロインは赤を、酸化されたフェロインはライトブルー(英語版)を呈する 。 発色が安定する時間は~30分後です。 発色条件(pH等)を再検討しけみたらいかがでしょうか。 1,10フェナントロリンが赤色になる件ですが、直射日光をさければ 1日位は大きな変化はないとおもいます。
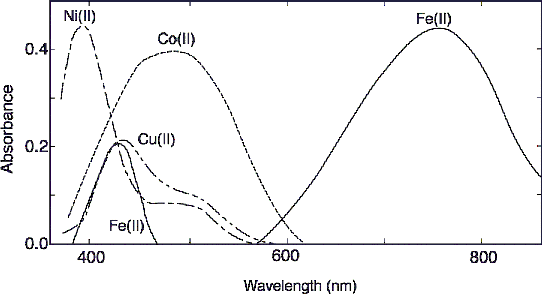
よって鉄試料0.1g以下の溶液化には,バナジウム(Ⅴ)溶液1mJを使用した。 4-3 フェナントロリン溶液の使用量 鉄(ⅠⅠ)・1,10-フェナントロリン錯体の組成はモル比で1:3である3)。一般的に呈全鉄又は全溶存鉄を定量する場合は,鉄(III)を鉄(II)に還元するために塩化ヒドロキシルアンモ ニウムを加える。 非溶存鉄,鉄酸化物,又は鉄錯体などが存在するときは,これらを溶かすために,前処 理が必要である(712参照)。 鉄(II)−1,10−フェナントロリン錯体はpH25〜9で安定であり,発色強度は鉄(II)の量に比例する。 濃 度と吸光度の直線関係は50mg/lまで成立する。 吸収極大 つまり、酸性してフェナントロリン上の孤立電子対の配位力を低下させる (→プロトン 付加)ことで、キレートを作るのに最もイオン半径が適している鉄だけが選択的に 配位するようになる、ということです。 (フェナントロリンは芳香族環上の窒素の孤立
フェナントロリン 鉄 発色 なぜ3.oフェナントロリンを添加する方法の検討 鉄(II)イオンとoフェナントロリンの1:3錯体 は濃赤色で,微量の鉄(II)イオンの検出に利用され, またこの濃赤色は鉄(III)錯体になるとあざやかに 変色(淡青色)するので,酸化還元指示薬(フェロ 一般的にフェナントロリンを用いた鉄(ii) イオンの比色定量法は、 酸 → 還元剤 → フェナントロリン → 緩衝液 の順鉄(iii)と 共存する鉄(ii)の1, 10 フェナントロリン 吸光光度定量法 大倉 与三郎* (1977年 12 月 27 日受理) これまで主として全鉄の定量に用いられていた1, 10フ ェナントロリン吸光光度法を,多 量の鉄(iii)158 ぶんせき Fundamental Konwledge of Chemical Analysis―Spectrophotometry 表1 ベールの法則が成立する要件 (1)入射光が単色光であること



ベロウソフ ジャボチンスキー Belousov Zhabotinsky 反応 フェロイン Fe Phen 32 は鉄イオンにo フェナントロリン が3個付いた錯体である この鉄が酸化されると青色の Fe Phen 33 になり 還元されると赤色の Fe Phen 32 に戻る 硫酸鉄 とo



フェナントロリン吸光光度法によるの鉄の定量
Coordination Chemistry dx配置から生じる各項間のエネルギー差(基底項から) 実測値を分光化学データより算出する dxイオンのRacahパラメータ及びスピン・軌道結合定数(ζ ) dx Mn B /cm1 C /cm1 ζ/cm1 3d2 Ti2 718 3630 1 V3 860 4165 210 3d3 V2 766 2855 170 Cr3 918 3850 275 3d4 Cr2 0 3430 230 Mn3 1140 3675 355鉄 鉄1000gをビーカーに採り、少量の硝酸(11)を加えて加熱溶解し、冷後、メスフ ラスコに移し、硝酸(1160)を加えて1Lとしたもの。 銅 銅1000gをビーカーに採り、少量の硝酸(11)を加えて加熱溶解し、冷後、メスフフェナントロリン試薬で鉄を吸光光度定量する場合の 発色操作では,ま ず試料溶液に塩酸ヒドロキシルアミ ン溶液を加え,そ の後0フ ェナントロリン溶液を,最 後に酢酸アンモニウム溶液を添加してメス



採泥による表面張力に関して質問です 写真をご覧ください 5mの槽 Yahoo 知恵袋



この問題が分かる方いらっしゃいますか 写真で答えて貰えると Yahoo 知恵袋
無機化学宿題 その4 石田 (1) (2) Al3 とハロゲン化物イオンからなる錯体の安定性は、F– > Cl– > Br– > I– であるのに対し、Ag とハ ロゲン化物イオンからなる錯体の安定性は、I– > Br– > Cl– > F– である。 1) HSAB の概念に基づいてこれを説明せよ。フェナントロリン 鉄 発色 なぜ鉄(iii)と 共存する鉄(ii)の1, 10 フェナントロリン 吸光光度定量法 大倉 与三郎* (1977年 12 月 27 日受理) これまで主として全鉄の定量に用いられていた1, 10フ ェナントロリン吸光光度法を,多 量の鉄(iii)できます。101 アルコール数測定法 23 一般試験法 一般試験法は,共通な試験法,医薬品の品質評価に有用な試 験法及びこれに関連する事項をまとめたものである.別に規定
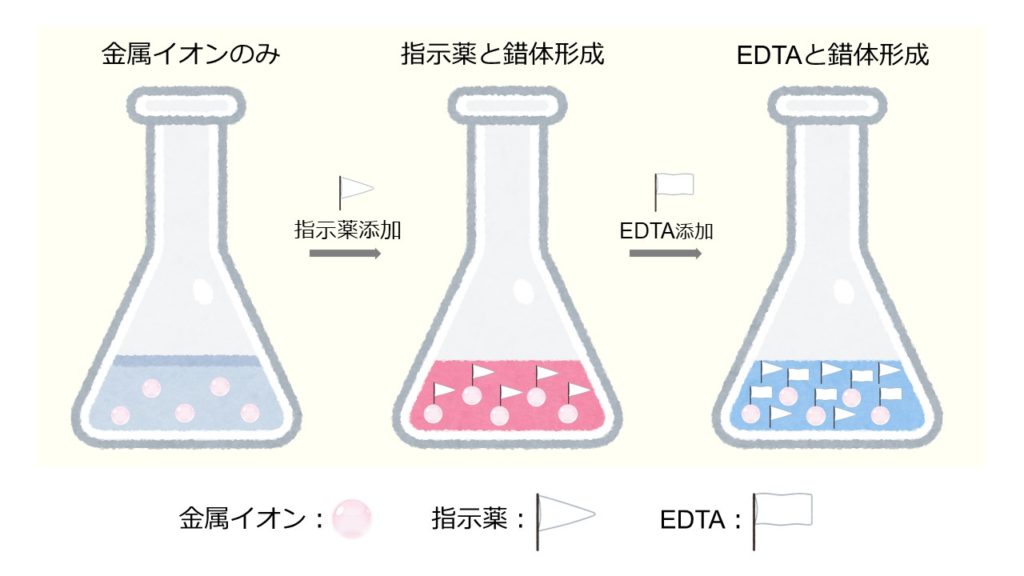



キレート滴定の原理とエチレンジアミン四酢酸 Edta の性質についてわかりやすく解説 ジグザグ科学 Com



2
試料に還元剤 (アスコルビン酸)と界面活性剤を含む緩衝剤を加えると、血清蛋白が変性し、結合していた鉄が遊離します。 遊離した鉄のうちFe 3 は、アスコルビン酸によりFe 2 に還元され、発色試液に含まれるバソフェナントロリンスルホン酸ナトリウムとキレート化合物を生成し赤色を呈します。 この赤色の吸光度を測定することにより試料中の鉄濃度を求める方法です。 バソフェナントロリ鉄 一 一→鉄クロロフイリン(緑色) →フユオフィチン(褐色) →銅クロロフィル(緑 色) この図からわかるようにクロロフィルのMgをCu・ Feと 置換する処理をすると安定な鮮かな緑色になる。 このことを利用して食品の着色料として用いられてい る。 鉄の単体は、 水素h 2 よりもイオン化傾向が大きく、希酸(塩酸や希硫酸など)と反応してh 2 を発生する。 ※イオン化傾向について詳しくはイオン化傾向(覚え方・定義・金属板の反応のしやすさ)を参照 ②不動態を形成 鉄の単体は、濃硝酸nho 3 と反応して不動態を形成する。




至急お願いいたします 化学 画像の物質は1 10 フェナントロリン錯体の Okwave



2
Phenanthroline(oフェナントロリン,または ophen)を配位子として過剰量添加する方法につい て検討した。 3.oフェナントロリンを添加する方法の検討 鉄(II)イオンとoフェナントロリンの1:3錯体 は濃赤色で,微量の鉄(II)イオンの検出に利用され,遷移金属と金属錯体~理論編~ 金属錯体 (complex)とは「 金属イオンに配位子が配位した化合物 」と定義されます。 金属錯体はそれぞれ独特の構造をしています。 たとえば鉄錯体イオンである Fe (CN)6 4 は正八面体構造をしています。 また、「触媒」と27 年内閣府令第10 号)別表第9の第3欄に掲げる方法の 詳細(以下「規定の方法」という。)は、本通知によることとする。



Fe測定方法について 血清鉄測定用 セロテック Fe L 製品案内 株式会社セロテック



2
「金属錯体の色、なぜなぜ?」 講師:鈴木 正樹(教授) 藤波 修平(准教授) 古館 英樹 (准教授) 錯体はどうして色をもつの? 塩化ナトリウム(食塩)や塩化アルミニウムの固体は白色をしていますが (また、鉄 (III)イオンは、塩基性条件下でコロイド状の沈殿を生成するので、それを防ぐために液性を酸性にする役割も担っているとも推測されます。 ) 次に、溶液中の鉄イオンがすべて鉄 (II)イオンのうちにoフェナントロリンを加え、発色の元となる「鉄 (II)イオン oフェナントロリン錯体」を作らせます。 ただし、oフェナントロリンは塩基性の化合物なので、酸性条件下だと一部 ②酢酸酢酸ナトリウム緩衝溶液を使用する理由 pHが低すぎるとフェナントロリンがFe (II)イオンと錯体形成するための不対電子対に水素イオンが配位した酸型になります。 このためFeが存在しても錯体が形成されず発色しません。 pHが高すぎると鉄は水酸化物の沈殿生成の可能性が生じます(Fe (II)の場合pH 7以上、Fe (III)の場合も考慮するとpHは5以下が望ましい)。 結果、酢



5144 8 1 10 フェナントロリン一水和物 1 10 Phenanthroline Monohydrate 161 169 詳細情報 常用試薬 ラボウェア 試薬 富士フイルム和光純薬



フェナントロリン法について教えてください 酢酸アンモを酸緩衝液として Yahoo 知恵袋
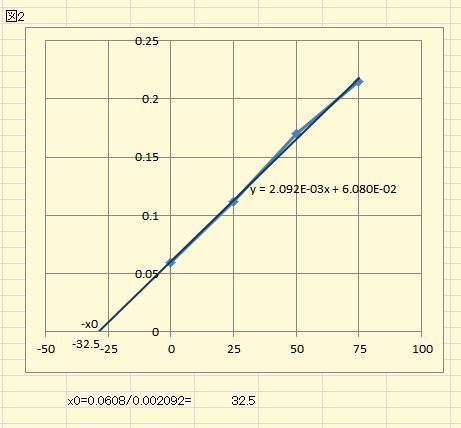
この定量実験はほぼ定番と言ってもよい実験ですが、見落とされがちなのは鉄濃度が高いと、フェナントロリンの量で発色が決まってしまうことです。 この処方では溶液中にフェナントロリンが28 µmol程度入っているわけで、鉄の量が09 µmol程度を超えると鉄が過剰になります。 いわば鉄ではなくフェナントロリンの定量のモードに入ってしまうのです。 ですからたとえば濃度未知の鉄の測JPB2 JPA JPA JPB2 JP B2 JP B2 JP B2 JP A JP A JP A JP A JP A JP A JP B2 JP B2 JP B2 Authority JP Japan Prior art keywords sample water iron water added dithionite Prior art date2.1,10フェナントロリン塩酸塩を用いて,溶液を調製 最終濃度が 4x10−4 M になるように,メスフラスコに採取 3.CH 3 COOH-CH 3 COONa を用いて,pH~5 の緩衝溶液を調製 最終濃度が 01 M になるように,メスフラスコに採取 4.510 nm で吸光度測定 試料の測定



2



フェナントロリン吸光光度法によるの鉄の定量
Coordination Chemistry §1 錯体化学の基礎 1 金属錯体とは 2 金属錯体の構造 3 金属錯体の異性現象 4 化学式と命名法Oフェナントロリンは早くから知られている鉄 (II)の比色試薬である。 感度面ではバソフェナントロリン、TPTS、NitrosoPSAPよりも低い。 oフェナントロリン鉄錯体は陰イオン対として有機溶媒に抽出されることより、陰イオンの間接的定量に用いられる 資料請求番号:ts74 ts84 ルビーの赤色の秘密 ルビーというのはダイヤモンドに次ぐ硬度を誇る宝石の一種で、7月の誕生石にもなっていますね。ルビーは石言葉として「熱情、情熱、純愛」称されるように、美しい赤色の宝石です。 今回は「ルビーがなぜ赤色をしているのか」について、



3回生実験のこと 光吸収 1 2



2
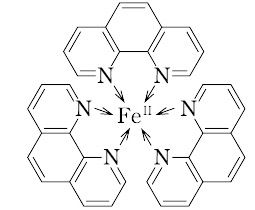



フェロインとは コトバンク



フェナントロリン鉄錯体の構造を教えてください フェナントロリンはベン Yahoo 知恵袋




分光光度計基礎講座 第4回 比色分析 吸光光度法 について 3 日立ハイテクサイエンス
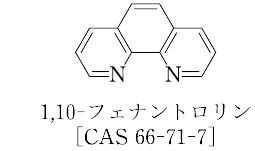



フェナントロリンとは コトバンク



食品学実験で無機質の定量 鉄の定量 をしました 結果は写真のように Yahoo 知恵袋



1 10 フェナントロリンと鉄との反応式をおしえてください Yahoo 知恵袋



2



2



2



3分でわかる技術の超キホン エレクトロクロミズムとは 色変化の例や注目の用途を解説 アイアール技術者教育研究所 製造業エンジニア 研究開発者のための研修 教育ソリューション



3



Fe測定方法について 血清鉄測定用 セロテック Fe L 製品案内 株式会社セロテック




カナル グランデ アマン カナル グランデ Mbaheblogjpfyse



2



フェナントロリン吸光光度法によるの鉄の定量




Lタイプワコー Uibc




19 号 リン光発光ダイオード中の単一トリフェニレン発色団 Astamuse



Fe測定方法について 血清鉄測定用 セロテック Fe L 製品案内 株式会社セロテック




5144 8 1 10 フェナントロリン一水和物 1 10 Phenanthroline Monohydrate 161 169 詳細情報 常用試薬 ラボウェア 試薬 富士フイルム和光純薬




最も共有された フェナントロリン 鉄 フェナントロリン 鉄 発色 なぜ Mbaheblogjpfyse



質問箱




最も好ましい 河村通夫 レシピ 河村通夫 レシピ こんにゃく Mbaheblogjpfyse



Chap6 03



1 10 フェナントロリン錯体による鉄の定量の実験の時の操作でわからないこ Yahoo 知恵袋



比色試薬 金属指示薬 Nitroso Psap 同仁化学研究所




19 号 リン光発光ダイオード中の単一トリフェニレン発色団 Astamuse



2



以下の分光光度法についての問題が全くわかりません 誰か教えて Yahoo 知恵袋



2



1 10 Phenanthroline 5144 8 東京化成工業株式会社




分光光度計基礎講座 第4回 比色分析 吸光光度法 について 3 日立ハイテクサイエンス




21 号 リン光発光ダイオード中の単一トリフェニレン発色団 Astamuse




フェナントロリン Wikipedia




最も好ましい 河村通夫 レシピ 河村通夫 レシピ こんにゃく Mbaheblogjpfyse



原子吸光分析法 この問題の解き方を教えてください 原子吸光分析法で鉄 Okwave



Core Ac Uk



Fe測定方法について 血清鉄測定用 セロテック Fe L 製品案内 株式会社セロテック



質問箱



1 10 フェナントロリンと鉄との反応式をおしえてください Yahoo 知恵袋



2



Fe測定方法について 血清鉄測定用 セロテック Fe L 製品案内 株式会社セロテック




至急お願いいたします 化学 画像の物質は1 10 フェナントロリン錯体の Okwave



3回生実験のこと 光吸収 1 1



試料1 00gから抽出してエバポレートし 移動相 ヘキサン イソプ Yahoo 知恵袋



ロックウールスクリーニング法



質問箱
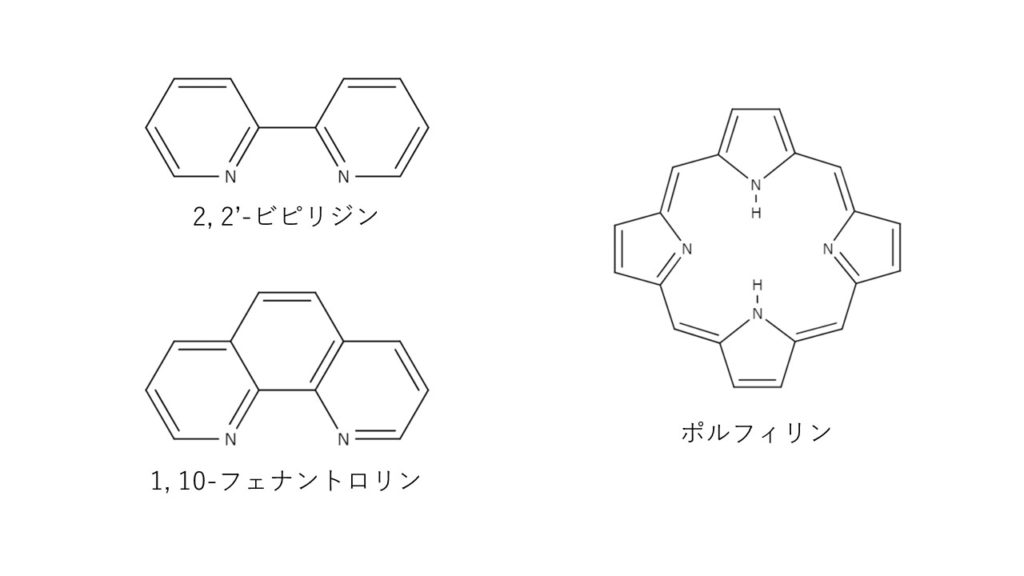



キレート滴定の原理とエチレンジアミン四酢酸 Edta の性質についてわかりやすく解説 ジグザグ科学 Com



食品学実験で無機質の定量 鉄の定量 をしました 結果は写真のように Yahoo 知恵袋



2



2



1




50 ダイソー ラバーカップ 洋式 ダイソー ラバーカップ 洋式



3回生実験のこと 光吸収 1 2




19 号 リン光発光ダイオード中の単一トリフェニレン発色団 Astamuse



食品添加物 発色剤の亜硝酸塩とボツリヌス菌についてです ハムと Yahoo 知恵袋



フェナントロリン吸光光度法によるの鉄の定量



1 10 フェナントロリンと鉄との反応式をおしえてください Yahoo 知恵袋




平成19年度成果報告書はこちら Jccls 特定非営利活動法人 Manualzz



鉄分の定量
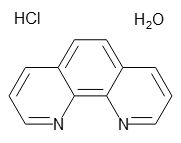



151 33 7 1 10 フェナントロリン塩酸塩一水和物 1 10 Phenanthroline Hydrochloride Monohydrate 168 164 166 160 詳細情報 常用試薬 ラボウェア 試薬 富士フイルム和光純薬



2



1



フェナントロリン鉄錯体の構造を教えてください フェナントロリンはベン Yahoo 知恵袋



化学での質問です 実験で鉄 1 10 フェナン Yahoo 知恵袋




原子吸光分析法 この問題の解き方を教えてください 原子吸光分析法で鉄 Okwave




フェナントロリン Wikipedia
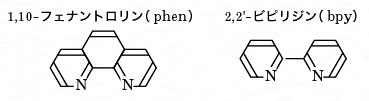



酸化還元指示薬とは コトバンク
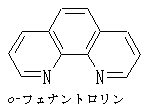



フェナントロリンとは コトバンク



フェナントロリン吸光光度法によるの鉄の定量




09 号 分光法のための分子色素 Astamuse



フェナントロリン Wikipedia



最も共有された フェナントロリン 鉄 フェナントロリン 鉄 発色 なぜ Mbaheblogjpfyse



2



フェナントロリン吸光光度法によるの鉄の定量



フェナントロリン吸光光度法によるの鉄の定量



Fe測定方法について 血清鉄測定用 セロテック Fe L 製品案内 株式会社セロテック



一番上の問題をエネルギー図をつかった解放を教えていただけると助かります Yahoo 知恵袋



甲南大学理工部機能分子科化学科 環境計測のための機器分析法



3



フェナントロリン鉄錯体の構造を教えてください フェナントロリンはベン Yahoo 知恵袋



2



電荷移動錯体 Wikipedia




フェロイン ことり さんのイラスト ニコニコ静画 イラスト



2




19 号 リン光発光ダイオード中の単一トリフェニレン発色団 Astamuse



Fe測定方法について 血清鉄測定用 セロテック Fe L 製品案内 株式会社セロテック




Iv 鉄の定量とタンパク質の分析 実験 東京大学教養学部基礎化学実験オフィシャルページ




17 号 リン光発光ダイオード中の単一トリフェニレン発色団 Astamuse



No comments:
Post a Comment